![]()
生命活動を担う最も基本的な分子であるタンパク質の構造と機能について、遺伝子工学ならびにX線結晶構造解析の手法などを用いて研究しています。主な研究対象は、抗生物質の生合成に関わる酵素、タンパク質分解酵素(プロテアーゼ)とその阻害剤(インヒビター)、タンパク質の立体構造形成を補助する分子シャペロン、そして繊維状集合体を形成するαへリックスなどで、それらの構造と機能の相関関係を明らかにすることを目標としています。
|
抗生物質の生合成に関わる酵素の構造と機能 |
|
|
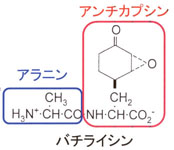
抗生物質は微生物の生育を阻止あるいは殺す物質で、様々な生物種から様々な構造をもつ物質が単離されています。アオカビ由来のペニシリンが特に有名な例で、抗生物質の発見は人類に大きく貢献してきました。それぞれの抗生物質について、標的となるタンパク質(酵素)を明らかにすることにより、その抗生物質の作用機序に関する分子機構が解明されています。たとえばペニシリンは細胞壁の、ストレプトマイシンはリボソームが関与するタンパク質の合成を抑制します。これら抗生物質の中で薬として使用されているものの多くは、有機化学的手法により合成されていますが、それらを合成する各生物種では、細胞内で様々な酵素が働くことにより合成されています。そこで、いくつかの抗生物質について、それらの細胞内での合成(生合成)に関わる酵素の働きを分子レベルで解明するために、遺伝子工学、立体構造解析などの手法を用いて解析を進めています。また、これらの酵素の改変により、活性が上昇した抗生物質や、新規な作用機序を示す抗生物質の創製が可能となるかもしれません。 |
|
|
|
|
|
プロテアーゼとその阻害剤(インヒビター)の構造と機能 |
|
|
プロテアーゼは、タンパク質代謝のみならず、細胞内シグナル伝達やアルツハイマー病など様々な病気の発症に深く関わっており、創薬の対象としても重要なタンパク質です。そこで、いくつかのプロテアーゼとそれらに特異的に結合する様々なインヒビターについて、その作用機序を分子レベルで詳細に理解するために、遺伝子工学、立体構造解析、ペプチド合成などの手法を用いて解析を進めています。特にタンパク質性のプロテアーゼインヒビターは、タンパク質でありながらプロテアーゼによって分解されるどころか、それらの働きを抑えてしまう、というユニークなタンパク質です。現在、下記に示すようなテーマで研究を進めています。 |
|
|
分子シャペロンによるタンパク質の立体構造形成機構の解明 |
|
|
ズブチリシンの成熟体領域のN末端側にはプロペプチドと呼ばれる領域があり、この部分を欠落させると活性を持ったズブチリシンが生成できないことから、プロペプチドはズブチリシン成熟体領域の立体構造形成(refolding)を補助する「分子内シャペロン」として働いていることがわかっています。またそれと同時に、ズブチリシンに阻害作用を示すことがわかっています。このようなユニークな性質を示すプロペプチドによるズブチリシンの立体構造形成補助作用について、さらに変異体を用いて解析を進めています。 |
|
|
|
|
|
αへリックス形成ペプチドによる繊維状集合体形成の分子機構 |
|
|
|
|
|
|
|
|
|
|
HOME > 研究内容
![]()