第4問
4−1 都市ガスの主成分はメタンで、その原料は天然ガスである。天然ガスはメタンのほかにエタン、プロパンなどの炭化水素を含んでいる。この天然ガスを約 -162℃ の低温にして液化したものが、液化天然ガスとしてタンカーで日本に運ばれてくる。
以下の問に答えなさい。解答に必要な化学反応式や計算式は、分かりやすく示しなさい。また、原子量はH 1、C 12、O 16としてよい。
(a) メタンの燃焼熱はいくらか。ただし、炭素Cの燃焼熱は394 kJ / mol、水素H2の燃焼熱は286 kJ / mol、また、炭素Cと水素H2からメタンをつくる反応の反応熱は、メタン1 molあたり75 kJである。
(b) 1.0 kg のメタンを燃やすと、どれだけの熱量が得られるか。また、そのとき、何kgの二酸化炭素が発生するか。
(c) メタンと水素はいずれも燃料として有用であるが、それぞれどのような特徴があるか。
1. 燃料としての特徴 2. 地球環境に対する影響
の両方について比較し、答えなさい。
4−2 以下の化学操作のうち、下線で示した過程でおこる変化を、化学反応式で答えなさい。
(a) 石灰石を900℃ 以上で加熱分解させた後、残った物に多量の水を加える。
(b) 銅粉を硝酸に溶解した後、この溶液に大過剰のアンモニア水を加える。
(c) 硫黄を空気中で燃焼させ、生じた気体を水酸化カリウム水溶液に通す。
(d) 硫酸鉄(II)水溶液に過剰の過酸化水素水を加えた後、この溶液に水酸化ナトリウム水溶液を滴下する。
(e) 炭酸バリウムを希塩酸に溶解した後、この溶液に硫酸アンモニウム水溶液を加える。
第5問
アルゴンは最初に発見された希ガス元素である。約100年前に、レーリーとラムゼー *1 は、「大気窒素」(大気から酸素と二酸化炭素と水蒸気を除いた気体)と「化学窒素」(酸化窒素の還元などの化学的方法で得た気体)の密度の違いに着目し、その原因を調べた結果、大気窒素の中にアルゴンが含まれていることを突き止めた。
彼らは、大気窒素から窒素を徹底的に除去して、残った気体の密度を測り、この気体の分子量は40であると結論した。 また比熱の測定から* 2この気体は単原子分子であることが分かったので、原子量が40ということになった。しかし、周期表の原子量40付近には、Cl 35.5、K 39、Ca 40、Sc 45といった元素がすでに並んでいて、原子量40のアルゴンを入れる場所がないという問題が生じた。周期表は元素を原子量の順に並べたものであると考えていた当時の人々にとって、これは大問題であった。
* 1 Lord Rayleigh and William Ramsay
* 2 このことは大学で学ぶ。今は知らなくてよい。
(a) アルゴンおよびアルゴンより軽い希ガス元素すべての、元素記号と原子番号を書きなさい。
(b) 一般に物質の密度を求めるためには、何と何を測ってどういう計算をすればよいか、簡潔に答えなさい。
(c) 乾燥した大気の体積組成は、窒素78 %、酸素21 %、アルゴン1 %である。(次に多いのは二酸化炭素の0.03 %であるが無視できる。)彼らの測定した大気窒素の密度は、同温同圧の化学窒素の密度より x % ほど大きかった。 xの値を上に記した組成を用いて計算しなさい。答えの有効数字は1桁でよい。必要なら、原子量として、N14、O 16の値を用いなさい。
(d) 気体の密度から分子量を求めるにはどうすればよいか、簡潔に答えなさい。必要があれば方程式を用いてよい。新たに用いる記号は、その意味を明記しなさい。
(e) ラムゼーは、化学的性質を重視してアルゴンを周期表中の現在の位置に置いた。それはどこか。原子番号の順で「何と何の間」というように答えなさい。
(f) ところで、原子番号の順とは結局何の順なのだろうか。簡潔に答えなさい。
第6問
6−1 5.0 gのシュウ酸ジエチルを、濃度0.50 mol / lの塩酸水溶液100 mlに加え、かき混ぜながら50℃で1時間加熱して、加水分解した。この溶液を中和するのに、濃度1.0 mol / lの水酸化バリウム水溶液45 mlを必要とした。
上の反応においてシュウ酸モノエチルは生成していないと仮定して、以下の問に答えなさい。
(a) 解答欄にシュウ酸ジエチルの化学式を示してある。これに他の化学式などを書き加えて、この物質の加水分解反応の反応式を完成しなさい。
(b) 加水分解の生成物を水酸化バリウムで中和する反応の反応式を書きなさい。
(c) はじめの反応で加水分解されなかったシュウ酸ジエチルの量を求めなさい。解答では計算の過程も示し、また、原子量はH 1、C 12、O 16としてよい。
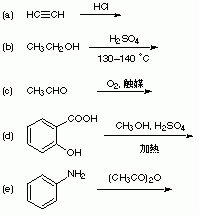
6−2 以下の化学変化における原料化合物の名称、および主生成物の構造式と名称を、解答用紙の該当する欄に書きなさい。
