1.憂栻僔乕僘偺暘巕僨僓僀儞偲働儈僇儖僶僀僆儘僕乕揑庤朄傪梡偄偨嶌梡婡彉夝柧
昦婥偺帯椕丄恌抐丄梊杊偺偨傔偺堛栻奐敪偵偍偄偰偼丄怴婯崪奿偺惗棟妶惈暔幙偺敪尒偑廳梫偱偁傝丄偙傟傜偼庡偵揤慠桳婡暘巕傗嬼慠偺妶惈敪尒偵傛偭偰尒偄弌偝傟偰偒偨丅 偙傟傜偺偄傢備傞揤慠宆惗棟妶惈暘巕偼惗懱撪偵偍偄偰偦偺昗揑偱偁傞庴梕懱僞儞僷僋摍偲憡屳嶌梡偟偰妶惈偑敪尰偟偰偄傞偲峫偊傜傟偰偄傞丅 尰嵼丄偑傫傪偼偠傔傑偩傑偩摿岠栻偺側偄昦婥偑偁傝丄傑偨怴偟偄昦婥偺敪尰偺壜擻惈傕偁傞丅 偦偆偄偭偨拞偱丄俀侾悽婭偺堛栻奐敪偵偍偗傞惗棟妶惈暘巕偺憂惢偵偼丄偙傟傑偱偺尋媶偲偼堎側傞傾僾儘乕僠偑昁梫偱偁傞丅 変乆偺尋媶幒偱偼丄堛栻慺嵽偲偟偰惗懱撪偵懚嵼偟側偄儂僂慺尦慺偵拝栚偟丄偙傟傪摫擖偟偨怴偟偄惗棟妶惈暘巕偺憂惢傪栚揑偲偟偰尋媶傪恑傔偰偄傞丅尰嵼丄偑傫偺暘巕昗揑帯椕栻偺奐敪傪栚巜偟偰丄
嘆 儕儞巁壔僔僌僫儖僇僗働乕僪偵拝栚偟偨僠儘僔儞僉僫乕僛慾奞嵻
嘇 僠儏乕僽儕儞廳崌慾奞嵻 偺憂栻尋媶
嘊 掅巁慺偱桿摫偝傟傞僔僌僫儖偵拝栚偟偨憂栻尋媶
嘋 儂僂慺偺摿惈傪妶偐偟偨憂栻尋媶傪恑傔偰偄傞丅
嘇 僠儏乕僽儕儞廳崌慾奞嵻 偺憂栻尋媶
嘊 掅巁慺偱桿摫偝傟傞僔僌僫儖偵拝栚偟偨憂栻尋媶
嘋 儂僂慺偺摿惈傪妶偐偟偨憂栻尋媶傪恑傔偰偄傞丅
恾1.1丂掅巁慺桿摫場巕乮俫俬俥乯偵娭傢傞僔僌僫儖揱払偲寣娗怴惗
丂丂丂
変乆偑昗揑偲偡傞僞儞僷僋偵摿堎揑偵嶌梡偡傞惗棟妶惈暘巕傪僐儞僺儏乕僞乕僔儈儏儗乕僔儑儞傪嬱巊偟偰愝寁丒崌惉偡傞偩偗偱側偔丄崌惉偟偨壔崌暔偺昗揑僞儞僷僋傊偺憡屳嶌梡偵偮偄偰傕暘巕惗暔妛揑庤朄傪梡偄偰挷傋丄峔憿妶惈憡娭傪柧傜偐偵偡傞偲偲傕偵丄偝傜側傞暘巕愝寁傪峴偭偰偄傞丅
丂偙偺傛偆偵丄杮尋媶幒偱偼桳婡壔妛傪婎幉偲偟偰暘巕惗暔妛偲偺嫬奅椞堟偵挧愴偟偰偍傝丄乽怴栻憂惢乿偲偄偆戝偒側柌偵岦偐偭偰擔栭尋媶偵椼傫偱偄傞丅
嵟嬤偺榑暥偐傜
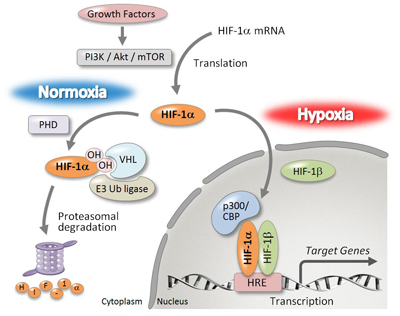
僇儖儃儔儞偺棫懱揹巕揑憡屳嶌梡傪棙梡偟偨HIF-1兛慾奞嵻丂丂丂丂丂丂丂丂丂丂丂丂丂惓忢慻怐偵偍偄偰偼丄敪払偟偨寣娗栐偵傛偭偰廫暘側巁慺丄塰梴偑嫙媼偝傟偰偄傞堦曽偱丄屌宍庮釃慻怐撪偱偼丄巁慺丒塰梴偑晄懌偟偰偄傞偙偲偐傜丄寣娗栐宍惉偺偨傔偵掅巁慺桿摫場巕(HIF: hypoxia inducible factor)- 1兛偵傛傞寣娗怴惗場巕偺嶻惗偑嫮偔槾恑偝傟偰偄傞1)丅偙偺傛偆側宱楬傪夘偟偰偑傫嵶朎偺憹怋傗怹弫丒揮堏傪懀恑偡傞偙偲偐傜丄掅巁慺壓偱桿摫偝傟傞HIF-1兛傪偑傫暘巕昗揑偲偟偨慾奞嵻偺尋媶奐敪偑嵟嬤拲栚偝傟偰偄傞丅
丂HIF-1兛偼丄捠忢桳巁慺壓忦審壓偱偼丄僾儘儕儞悈巁壔峺慺(PHD: prolyl hydroxylase)偱悈巁壔偝傟丄儐價僉僠儞儕僈乕僛(VHL: von Hippel-Lindau)偵傛傝儐價僉僠儞壔偝傟僾儘僥傾僜乕儉暘夝宱楬傪宱偰暘夝偝傟傞丅堦曽丄掅巁慺忦審壓(Hypoxia)偱偼丄PHD偵傛傞悈巁壔偑梷惂偝傟傞偨傔丄HIF-1兛偼暘夝偝傟偢妀撪傊偲堏峴偟丄HIF-1兛偲僿僥儘擇検懱傪宍惉偟DNA偺掅巁慺墳摎椞堟(HRE: hypoxia response element)偵寢崌偡傞偙偲偱丄條乆側寣娗怴惗場巕偑妶惈壔偝傟傞乮恾1乯丅
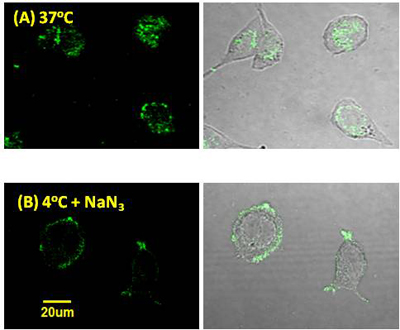
丂変乆偼丄HIF-1兛慾奞嵻偲偟偰丄儂僂慺僋儔僗僞乕崪奿傪桳偡傞GN26361傪尒弌偟偨乮恾2乯丅GN26361偼丄HIF-1兛偺mRNA儗儀儖傪慾奞偡傞偙偲側偔HIF-1兛僞儞僷僋偺拁愊側傜傃偵偦偺壓棳堚揱巕VEGF偺敪尰傪慾奞偟偨丅偦偙偱丄GN26361偺壔妛峔憿傪婎偵丄岝斀墳偵傛傝昗揑僞儞僷僋偲嫟桳寢崌傪宍惉偡傞岝斀墳惈姱擻婎儀儞僝僼僃僲儞傪摫擖偟丄偝傜偵傾僕僪娷桳寀岝嵻偲偺僋儕僢僋斀墳儔僀僎乕僔儑儞偺偨傔偵枛抂傾僙僠儗儞傪摫擖偟偨GN26361僾儘乕僽暘巕傪崌惉偟偨丅僾儘乕僽暘巕偲斀墳偝偣偨HeLa嵶朎儔僀僙乕僩傪SDS-PAGE傪峴偄丄寀岝僀儊乕僕儞僌僔僗僥儉偵偰僾儘乕僽暘巕偲寢崌偟偨僞儞僷僋偺摨掕傪丄幙検暘愅憰抲乮LC/ESI-TOF-MS乯傪梡偄偰儁僾僠僪儅僗僼傿儞僈乕僾儕儞僥傿儞僌朄偵傛傝峴偭偨丅偦偺寢壥丄GN26361偺昗揑僞儞僷僋偺侾偮偑Hsp60 (Heat shock protein 60) 偱偁傞偙偲傪柧傜偐偵偟偨丅(Bioorg. Med. Chem. Lett., 2010, 1453-1456; J. Am. Chem. Soc. 2010, 132, 11870-11871偵傛傝榑暥敪昞嵪)
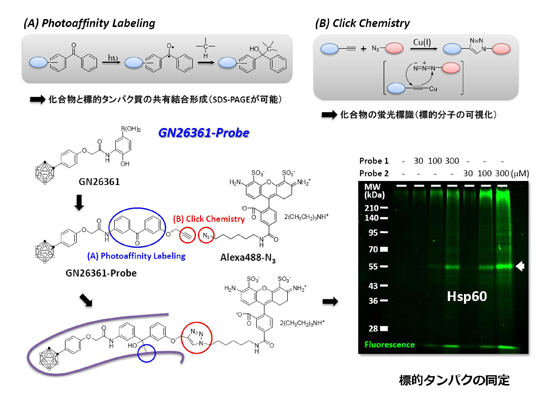
恾1.2丂僇儖儃儔儞偺棫懱揹巕揑憡屳嶌梡傪棙梡偟偨HIF-1兛慾奞嵻偺壔妛峔憿偲働儈僇儖僾儘乕僽壔偵傛傞昗揑僞儞僷僋偺摨掕僾儘僙僗丏Hsp60偑HIF-1兛偺埨掕壔偵娭傢偭偰偄傞偙偲偑弶傔偰柧傜偐偲側偭偨丅
2. 拞惈巕曔懆偑傫帯椕偺偨傔偺師悽戙儂僂慺僫僲僉儍儕傾乕偺奐敪
偑傫帯椕偺棟憐揑側曽朄偲偼丄惓忢慻怐偵廳戝側忈奞傪梌偊傞偙偲側偔丄偑傫嵶朎傪嶦偡偙偲偱偁傞丅偑傫傪帯偡偨傔偵偼丄偑傫嵶朎傪姰慡偵嶦偝側偗傟偽側傜側偄偑丄偦偺帯椕朄偺偨傔偵偼偟偽偟偽懠偺惓忢慻怐傕彎偮偗偰偟傑偆丅崱擔偺昗弨揑帯椕朄偱偁傞奜壢庤弍丄曻幩慄椕朄丄柶塽椕朄丄壔妛椕朄偺慻傒崌傢偣偱壗庬椶偐偺偑傫傪帯偡偺偵惉岟偟偰傕丄偦傟傜偺曽朄偱偼帯偡偙偲偺偱偒側偄偑傫偑傑偩傑偩懡偔懚嵼偡傞丅
偟偐偟丄怴偟偄嫮椡側帯椕朄傪惗傒弌偣傞壜擻惈傕偁傝丄偦偺堦偮偵偼儂僂慺拞惈巕曔懆椕朄偑偁傞丅掅僄僱儖僊乕偺擬拞惈巕偼僄僱儖僊乕偺崅偄崅懍拞惈巕偲偼堎側傝丄恖懱偵偼柍奞偱偁傞丅
偟偐偟側偑傜擬拞惈巕偲儂僂慺10偲偺斀墳偼丄儕僠僂儉偲僿儕僂儉乮兛慄乯傪惗偠丄偙傟傜偺僄僱儖僊乕偼2.4MeV偲偍傛偦侾偮偺嵶朎傪攋夡偡傞偺偵廫暘側僄僱儖僊乕偱偁傞乮幃1乯丅
10B + 1n 仺 7Li + 4He + 2.4 MeV丂 (1)
偙偺妀斀墳傪棙梡偡傞偺偑儂僂慺拞惈巕曔懆椕朄偱偁傞丅
偟偨偑偭偰丄梊傔儂僂慺暘巕傪偑傫嵶朎偵偺傒慖戰揑偵庢傝崬傑偣偦偙傊拞惈巕徠幩傪峴偊偽丄嵶朎撪偱偺儂僂慺偲拞惈巕偺妀斀墳偱惗惉偡傞兛慄偺僄僱儖僊乕傪梡偄偰偑傫嵶朎偺傒傪慖戰揑偵攋夡偡傞偙偲偑偱偒傞丅
堦愄慜傑偱偼丄擬拞惈巕偺傒傪庢傝弌偡偙偲偼崲擄偱偁偭偨偑丄尨巕楩暔棟妛偺敪揥偵傛傝丄椙岲側拞惈巕偑摼傜傟傞傛偆偵側偭偨丅
傑偨丄擬拞惈巕偼壛懍婍偐傜傕摼傞偙偲偑偱偒傞傛偆偵側偭偨偑丄尨巕楩偐傜摼傜傟傞擬拞惈巕傛傝傕傑偩傑偩弌椡偑庛偄偙偲偑栤戣揰偱偁傞丅
尰嵼丄妀擱椏偺栤戣偐傜堛椕梡尨巕楩偺棙梡偐傜壛懍婍偺棙梡傊偲揮姺偟偮偮偁傝丄壛懍婍偵傛傞儂僂慺拞惈巕曔懆椕朄偺幚尰偺偨傔偵傕丄儂僂慺10傪娷傓暘巕傪擛壗偵偟偰偑傫嵶朎偵偺傒慖戰揑偵崅擹搙偱憲傝崬傓偐偑帯椕岠壥偺寛傔庤偲側傞丅
杮尋媶幒偱偼丄堛妛丄尨巕楩暔棟妛丄栻妛偺奺暘栰偺尋媶幰偲嫟摨偱廤妛揑尋媶傪恑傔偰偄傞丅
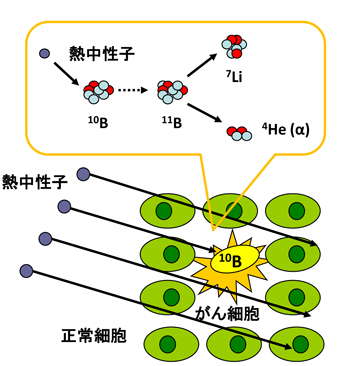
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂恾2.1丂拞惈巕曔懆椕朄偺奣擮恾
嵟嬤偺榑暥偐傜
儂僂慺僀僆儞僋儔僗僞乕帀幙偺崌惉偲儀僔僋儖壔丗儂僂慺拞惈巕曔懆椕朄偺偨傔偺儂僂慺憲払僔僗僥儉傊偺墳梡
嬤擭丄儂僂慺10暘巕偺偑傫慻怐傊偺桳岠側憲払朄偲偟偰僪儔僢僌僨儕僶儕乕僔僗僥儉偺棙梡偑拲栚偝傟偰偄傞丅堦斒偵儕億僜乕儉傪棙梡偟偨僪儔僢僌僨儕僶儕乕僔僗僥儉偱偼丄儂僂慺10暘巕偺傛偆側偑傫嵶朎傊憲払偟偨偄栻嵻傪儕億僜乕儉偺撪懁偵暵偠崬傔僨儕僶儕乕偡傞偨傔丄晻擖偱偒傞栻嵻偺擹搙偵偼尷奅偑偁偭偨丅変乆偼丄儕億僜乕儉偺擇暘巕枌偵拲栚偟偨丅
帀幙擇暘巕枌偼丄暘巕娫憡屳嶌梡偵傛傝帺屓廤崌壔偟偰偄傞偨傔枾搙偑崅偔丄偙偺擇暘巕枌傊儂僂慺暘巕傪摫擖偱偒傟偽丄旕忢偵崅擹搙偱儂僂慺傪僨儕僶儕乕偱偒傞偲峫偊傜傟傞丅
杮尋媶幒偱偼丄偙偺儕億僜乕儉偺擇暘巕枌傊儂僂慺暘巕摫擖傪巜岦偟偨儂僂慺僀僆儞僋儔僗僞乕帀幙傪奐敪偟偰偄傞丅乽師悽戙DDS宆埆惈庮釃帯椕僔僗僥儉偺尋媶奐敪帠嬈乿乮怴僄僱儖僊乕丒嶻嬈媄弍憤崌奐敪婡峔乮NEDO乯丗暯惉侾俈擭搙乣暯惉侾俋擭搙乯偵偍偄偰丄拀攇戝妛丒戝嶃戝妛丒嫗搒戝妛丒擔杮尨巕椡尋媶奐敪婡峔丄偍傛傃崙撪婇嬈偲杮尋媶偺幚梡壔偵岦偗偰嫟摨尋媶傪恑傔丄暯惉20擭搙傛傝岤惗楯摥徣偺乽堛椕婡婍奐敪尋媶帠嬈乮僫僲儊僨傿僔儞尋媶帠嬈乯乿偵偍偄偰拀攇戝妛丒戝嶃戝妛丒嫗搒戝妛丒掗嫗戝妛丒搶嫗戝妛偲椪彴墳梡傊岦偗偨奐敪尋媶傪恑傔偰偄傞丅(Bioconjugate Chem. 2006; Bioorg. Med. Chem., 2010; Pharm. Tech. Japan, 2010乯丅
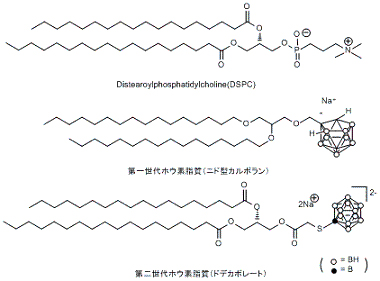

恾2.2丂儂僂慺僀僆儞僋儔僗僞乕帀幙偺峔憿 偲 偦偺儀僔僋儖宍惉乮揹巕尠旝嬀幨恀乯
3. 桳婡崌惉偺偨傔偺怴偟偄暘巕曄姺斀墳偺奐敪
師悽戙暔幙曄姺僾儘僙僗偲偟偰朷傑傟傞偙偲偼丄娐嫬挷榓宆偺僄僐働儈僗僩儕乕偵懳墳偟偨崅搙暔幙曄姺僾儘僙僗傪奐戱偡傞偙偲偱偁傞丅杮尋媶幒偱偼丄慗堏嬥懏怗攠傪梡偄偨崅岠棪揑崌惉斀墳偺奐敪傪峴偭偰偄傞丅嵟嬤偺榑暥偐傜
僾儘僷儖僊儖傾儈儞傪崌惉拞娫懱偲偡傞暘巕曄姺斀墳惗棟妶惈暔幙傗栻嵻偺傛偆偵変乆偺惗妶偵偍偄偰廳梫側掅暘巕壔崌暔偺懡偔偼丄娷拏慺壔崌暔偱偁傞偙偲偐傜丄扽慺亅拏慺寢崌偺妶惈壔偵婎偯偔暘巕曄姺偼丄桳婡崌惉忋傕偭偲傕廳梫側曄姺斀墳偺堦偮偱偁傞丅摿偵丄偦偺怗攠揑暘巕曄姺斀墳偺奐戱偼丄偄傢備傞娐嫬偵桪偟偄壔妛崌惉丄娐嫬偵桪偟偄暘巕綁瀭虗輰v偺偨傔偵傕媄弍婎斦偲側傞娐嫬挷榓宆偺幚慔揑桳婡崌惉僾儘僙僗偺奐戱偵宷偑傞丅変乆偼丄娷拏慺壔崌暔偺拞偱傕摿偵僾儘僷儖僊儖傾儈儞傪崌惉拞娫懱偲偡傞暘巕曄姺斀墳偵拝栚偟尋媶傪恑傔偰偄傞丅
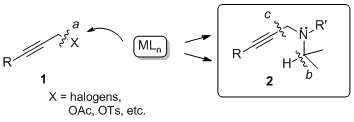
丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂丂恾3.1丂僾儘僷儖僊儖壔崌暔偺斀墳惈
僾儘僷儖僊儖壔崌暔傪梡偄傞暘巕曄姺斀墳偼丄扽慺亅扽慺嶰廳寢崌傪摫擖偱偒傞偩偗偱側偔丄偦偺姱擻婎傪棙梡偟晅壛斀墳傗娐壔斀墳側偳崅搙側崪奿曄姺偑壜擻偱偁傞偙偲偐傜桳婡崌惉偵偍偄偰旕忢偵廳梫側斀墳偺1偮偱偁傞丅堦斒揑偵丄抲姺斀墳偵偍偄偰梡偄傜傟傞僾儘僷儖僊儕儖壔崌暔乮1乯偼丄扙棧婎偵僴儘僎儞傕偟偔偼僄僗僥儖側偳扙棧惈偺崅偄姱擻婎傪桳偟偰偍傝丄嬥懏怗攠偑扽慺亅僿僥儘尨巕寢崌偵巁壔揑憓擖偡傞偙偲偱斀墳偑恑峴偟偰偄傞乮path a乯丅堦曽丄変乆偼僾儘僷儖僊儖傾儈儞桿摫懱乮2乯偵懳偟偰偼丄摨條偺巁壔揑憓擖斀墳偩偗偱側偔丄拏慺尨巕偵寢崌偟偰偄傞扽慺亅悈慺寢崌傪妶惈壔偡傞偙偲偵傛傝僸僪儕僪揮埵偑婲偙傝乮path b乯丄傾儗儞傊偲曄姺偝傟傞偙偲傪尒弌偟偨 (J. Am. Chem. Soc. 2004) 丅偝傜偵丄戞擇媺傾儈儞懚嵼壓偱偼嬥懏怗攠偑sp扽慺亅sp3扽慺寢崌偵巁壔揑憓擖斀墳偑婲偙傝乮path c乯丄傾儈儞抲姺斀墳偑恑峴偡傞偙偲傪尒弌偟偨(J. Am. Chem. Soc. 2010) 丅偙傟傜偺儐僯乕僋側斀墳偵偼拏慺尨巕忋偺旕嫟桳揹巕懳偑廳梫側栶妱傪壥偨偟偰偍傝丄嬥懏怗攠偺巁壔揑憓擖傪傾僔僗僩偟偰偄傞偲峫偊傜傟傞丅
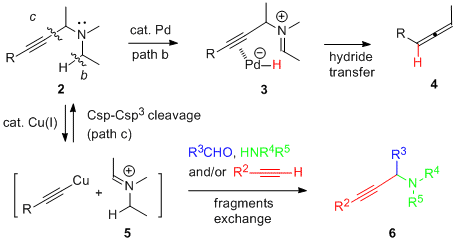
丂丂丂丂丂丂恾3.2丂僷儔僕僂儉怗攠偍傛傃摵怗攠偵傛傞儐僯乕僋側暘巕曄姺斀墳婡峔