学習院大学 理学部 化学科 / 自然科学研究科 化学専攻 岩田研究室
岩田研究室
専門的な内容については,こちらをご覧ください.
<近赤外ラマン分光法>
ラマン分光法は,基本的な分子から,生きた細胞や機能性高分子材料までのさまざまな試料について,分子の構造を調べることができる最も基本的な手法のひとつです.現在では,物理化学の分野だけでなく,他の化学分野,生命科学分野,医学分野にわたって役立つ分析方法として注目を集めています.
実は,ラマン分光法には2つの問題点があります.1つめは,試料がけい光を出す場合はラマンスペクトルの測定が難しくなります.けい光はラマン散乱とは比較にならないほど強いので,ラマン散乱による信号はけい光に埋もれてみえなくなります.2つめは,ラマン散乱をみるには比較的強い光を試料にあてる必要があることです.試料のなかには,強い光によってかんたんに傷んでしまうものもあります.
このような問題に対する解決策はいくつかありますが,いちばん直接的な方法は,近赤外光をあててラマンスペクトルを測ることです.近赤外光の光子エネルギーが小さいため,ほとんどの試料はけい光を発する状態になることはありませんし,試料が傷んでしまう可能性も小さくなります.
<近赤外ラマン分光法の問題点>
ところが,近赤外のラマン散乱はとても弱いことが問題となります.試料にあてる光の振動数をx, 発生するラマン散乱光の振動数をyとすると,ラマン散乱の強さはyの3乗およびxに比例します.したがって,近赤外光をあてて発生させたラマン散乱の強さは,可視光をあてた場合の約1/20しかありません.さらに,ラマン散乱光の検出器の性能も問題です.現在,世界最高の性能を持つ近赤外検出器(当研究室にはありません.とても高価です!)でさえ,感度はCCDカメラの約1/20です.これらを合わせると,近赤外ラマン散乱をみたときの信号の強さは,可視光のラマン散乱をみた場合の約1/400しかないことになるのです.
<近赤外誘導ラマン分光法>
そこで,わたしたちは少し難しい方法でラマンスペクトルを測ることにしました.それは,「誘導ラマン分光」とよばれる方法です.図1をみてください.まず,ふつうにラマン散乱を発生させるように,強い近赤外レーザー光(ラマンポンプ光)を試料にあてます.そして,このときにラマン散乱光と同じ振動数の弱い近赤外レーザー光(プローブ光)を試料にあてるのです.これらの2本のレーザー光によって,非常にたくさんの試料分子がいっせいに振動します.その結果,プローブ光が強められて試料を通過してきます.これが「誘導ラマン散乱」とよばれる現象です.この方法でみることのできる振動は,ラマンスペクトルでみえる振動と同じになります.
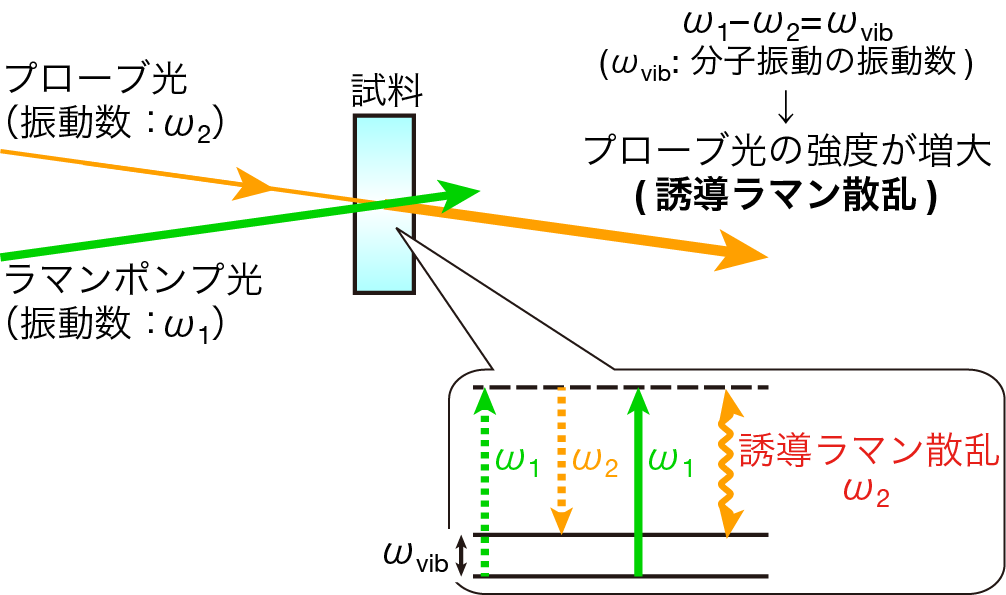
図1 誘導ラマン散乱
この方法でも,信号が小さいことには変わりありません.信号が強められるとは言ってもわずかです.しかし,光の強さのわずかな変化を調べることにかけては,わたしたちはたくさんの技術と経験を持っています.わたしたちは次のような分光計をつくりました.
<フェムト秒時間分解マルチプレックス近赤外誘導ラマン分光計>
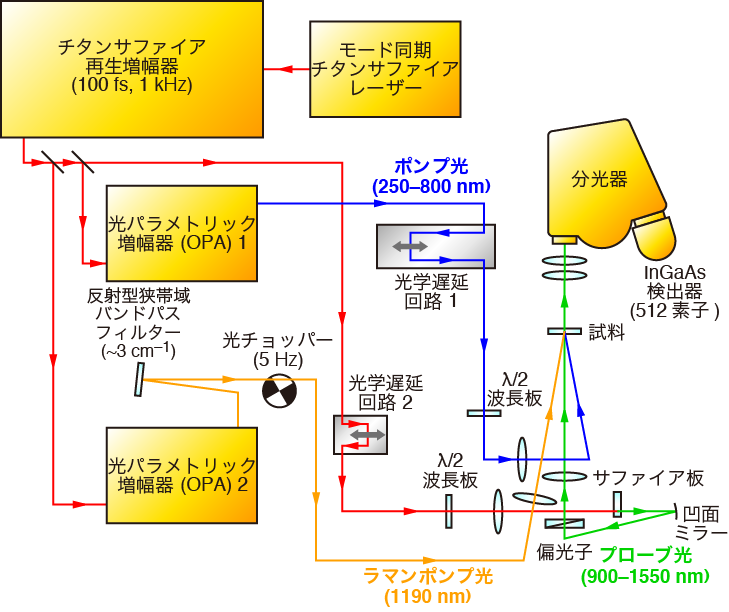
図2 フェムト秒時間分解マルチプレックス近赤外誘導ラマン分光計
わたしたちはこの分光計をフェムト秒時間分解マルチプレックス近赤外誘導ラマン分光計とよんでいます.この分光計を用いると,ひじょうに短い時間しか存在することのできない分子種の近赤外誘導ラマンスペクトルを一度に測ることができます.
分光計の概略を図2に示します.光源はフェムト秒パルスレーザーです.この光パルスを3つに分けます.1つめは分子に化学反応を起こさせるための光パルス(ポンプ光)で,光パラメトリック増幅器(OPA)とよばれる波長変換器を用いて発生させます.ポンプ光の波長は紫外〜可視(250〜800 nm)の範囲で自由に選べます.2つめの光パルスはラマンポンプ光です.こちらもOPAを用いて発生させており,波長は1190 nmです.ラマンポンプ光の「単色さ」は,誘導ラマンスペクトルの波数をどれだけ細かく分解できるかと密接に関係しています.この分光計では,反射型のバンドパスフィルターを用いてラマンポンプ光の波数の幅を3 cm-1程度まで小さくしています.3つめの光パルスはプローブ光です.この光は,チタンサファイアレーザーの光をサファイアの板に緩く絞ることで発生します.波長はとても幅広く,900〜1550 nmの光が一度に発生します.この光を一度にまとめて用いることで,誘導ラマンスペクトルを一度に測定することができます.
3種類の光パルスを次のように試料にあてます.まず,ポンプ光を試料にあて,試料分子に化学反応を起こさせます.次に,反応中にできた非常に寿命の短い分子種にラマンポンプ光とプローブ光を同時にあてます.誘導ラマン散乱が起こると,試料を通過したプローブ光のうち,ラマン散乱と同じ振動数の光だけが強められます.このプローブ光を分光器とInGaAs検出器(512素子)で分析します.化学反応による変化を時間ごとに追跡するには,ポンプ光が試料に着くまでのタイミングを光学遅延回路1で少しずつ変えていきます.光学遅延回路2は,ラマンポンプ光とプローブ光が同時に試料に着くようにタイミングを整える役割を持っています.
<β-カロテンS2状態の誘導ラマンスペクトル測定>
β-カロテンといえば,多くの方が名前を一度は耳にしたことがあるのではないでしょうか.ほうれん草やにんじん,かぼちゃなどにたくさん含まれている栄養素です.この分子は,実は図3のような構造をしています.
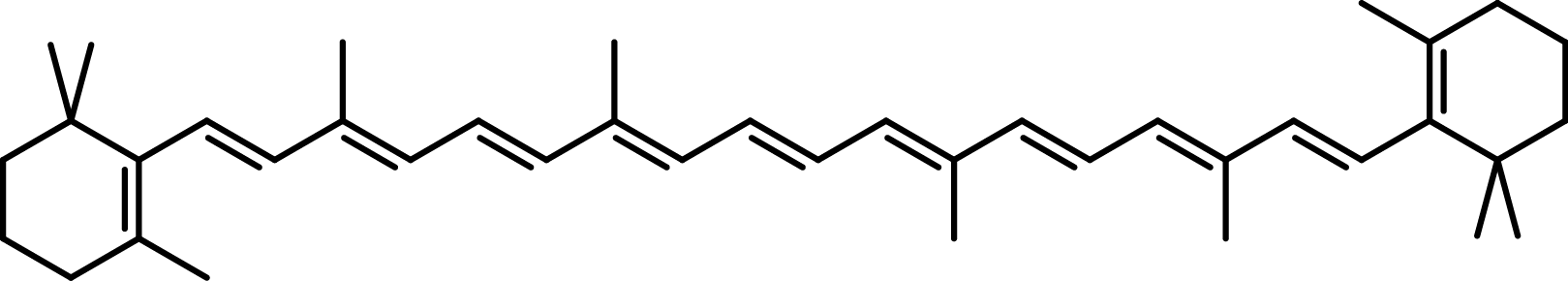
図3 β-カロテンの構造
中央にたくさんの二重結合と単結合が交互に入っています.このような構造があるとき,電子はその中を比較的自由に運動することができます.その結果,β-カロテンは青い光をよく吸収します.β-カロテンの色はにんじんのような赤色ですが,その原因はβ-カロテン分子の構造にあるのです.
では,光を吸収したβ-カロテンはどうなるのでしょうか.これまでの研究ですと,光を吸収した直後のβ-カロテン(S2状態といいます)は,約200フェムト秒というひじょうに短い時間でもう少しエネルギーの低い状態(S1状態)に変わります.そして,約10ピコ秒でもとのβ-カロテンに戻ってしまいます.ほうれん草の中に含まれるβ-カロテンは,光を吸収して得たエネルギーをこれだけ短い時間の間にクロロフィルに渡すことができるといわれています.こうして集められたエネルギーが,光合成に使われていくのです.
さて,光を吸収したばかりのβ-カロテン(S2状態)については,実はあまりよく分かっていません.あまりに寿命が短いので,ラマンスペクトルを測ることがとても難しかったのです.しかも,S2状態のラマンスペクトルを効率よく測定するには近赤外ラマン分光計が必要だったことも問題でした.
そこで,わたしたちはフェムト秒時間分解マルチプレックス近赤外誘導ラマン分光計を用いて,β-カロテンのS2状態の誘導ラマンスペクトルを測定しました.β-カロテンに波長480 nmのポンプ光をあて,次にラマンポンプ光とプローブ光をあてて誘導ラマンスペクトルを記録しました.図4のように,β-カロテンのS2状態による誘導ラマン散乱が1580, 1240, 1050 cm-1の位置にはっきりとみられました.スペクトルの幅がとても大きいですが,これはS2状態の寿命が短いことが原因です.
次に,ポンプ光の波長を403 nmに変えてみました.すると,S2状態の誘導ラマンバンドの位置が1555 cm-1となりました.このような情報から,S2状態にあるβ-カロテンの振動のようすを調べることができます.
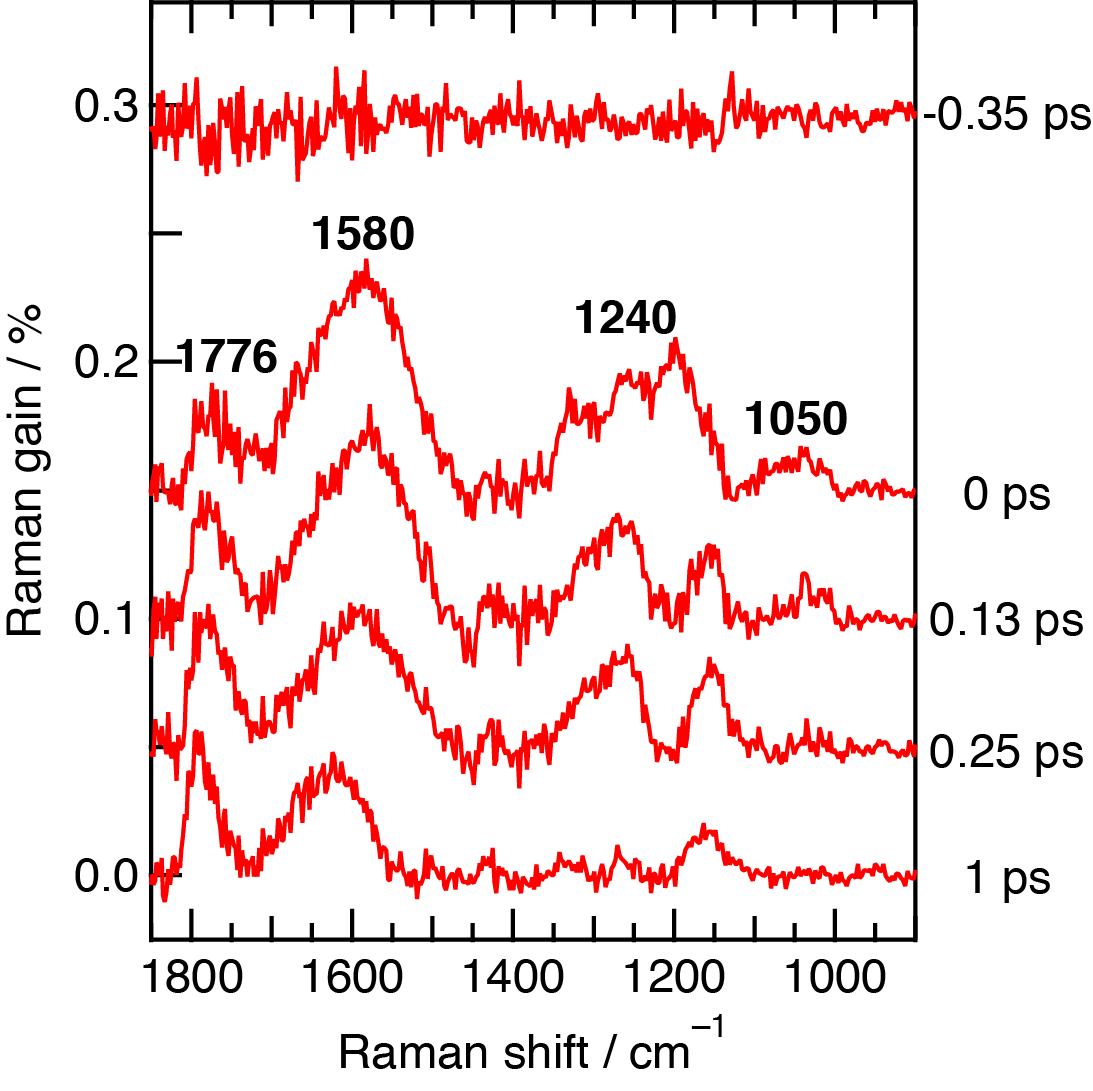
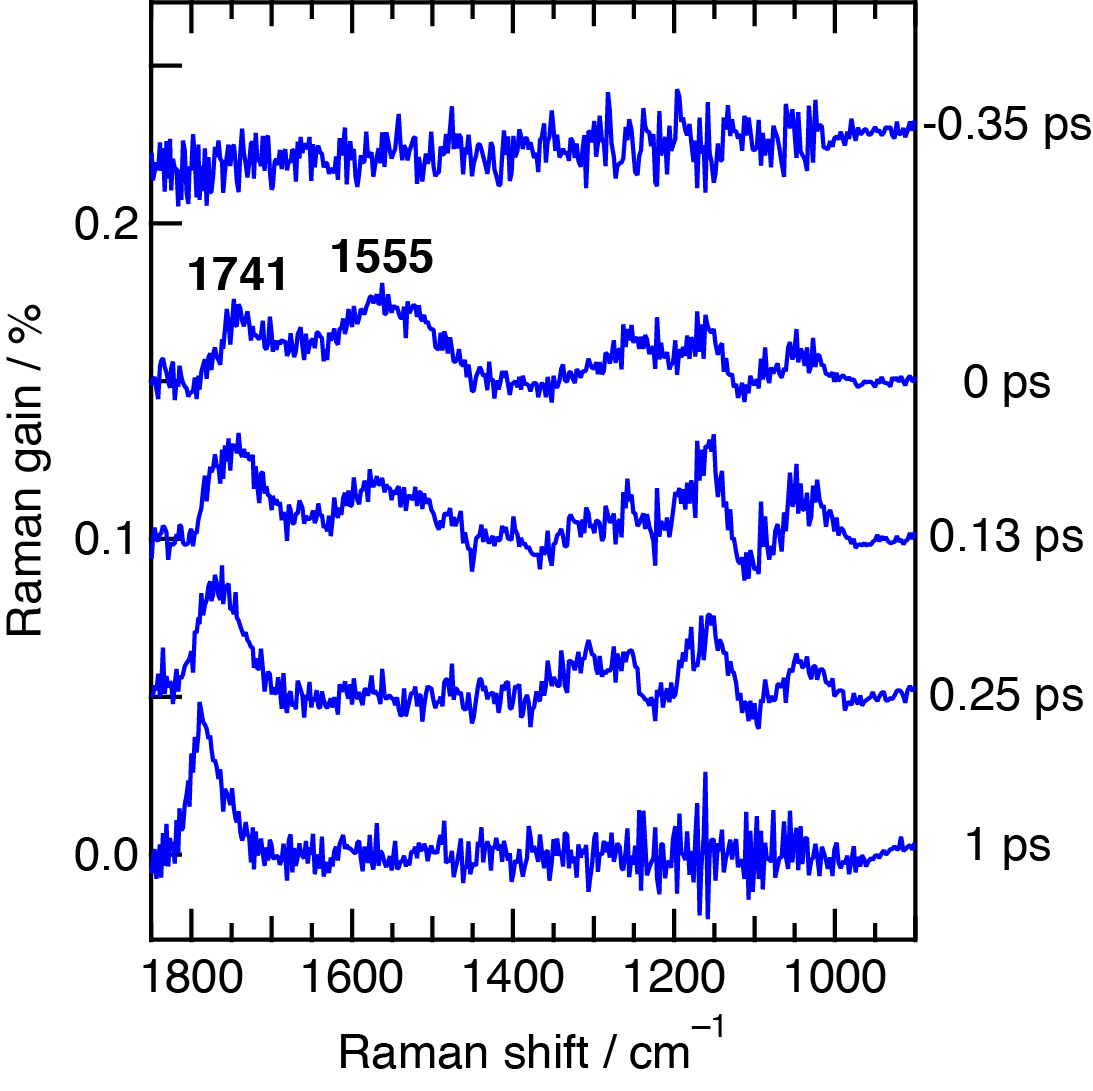
図4 (左)β-カロテンを波長480 nmの光で励起して測定したフェムト秒時間分解近赤外誘導ラマンスペクトル (右)β-カロテンを波長403 nmの光で励起した場合の近赤外誘導ラマンスペクトル
もう少し専門的な内容については,こちらをご覧ください.