研究テーマ02
中分子創薬へ向けた翻訳後修飾ペプチドの生合成研究
分子量500〜2,000 の中分子化合物を用いた創薬は、抗体などのバイオ医薬品と同等の基質特異性を示し、低分子並みに安価に製造できるという利点がある。中分子の中でもペプチド系天然物は発酵による生産が可能であるため、合成ペプチドよりも製造コストが著しく低いため、注目されている。
微潜研ではRiPPs(Ribosomally synthesized and post-translationally modified peptides)と呼ばれるリボソームによって翻訳合成された後に修飾酵素によってアミノ酸が修飾されるペプチド系化合物群に注目し、ゴードスポリン、ラクタゾール、ゴードビオニンの3つの生合成機構を解明し、多様なRiPPs 類縁体創製を行っている。RiPPsは翻訳後修飾を受けているため、通常のペプチドに比べ、3次元構造を取りやすくターゲットとの高親和性を発揮する。また、ペプチダーゼなどによる分解を受けにくくなるため、細胞内で安定である利点がある。
(1) ラクタゾール:最小単位の生合成系で生成するチオペプチド
チオペプチドはゴードスポリンと同様にリボゾーム翻訳系を介して生合成される抗生物質の一群ですが、多剤耐性菌に対して強力な抗菌活性を有することから、特に有力な化合物群です(図1-1)。このため、チオペプチド生合成マシナリーは有用物質生産に適した有力な生合成システムであると考えられています。
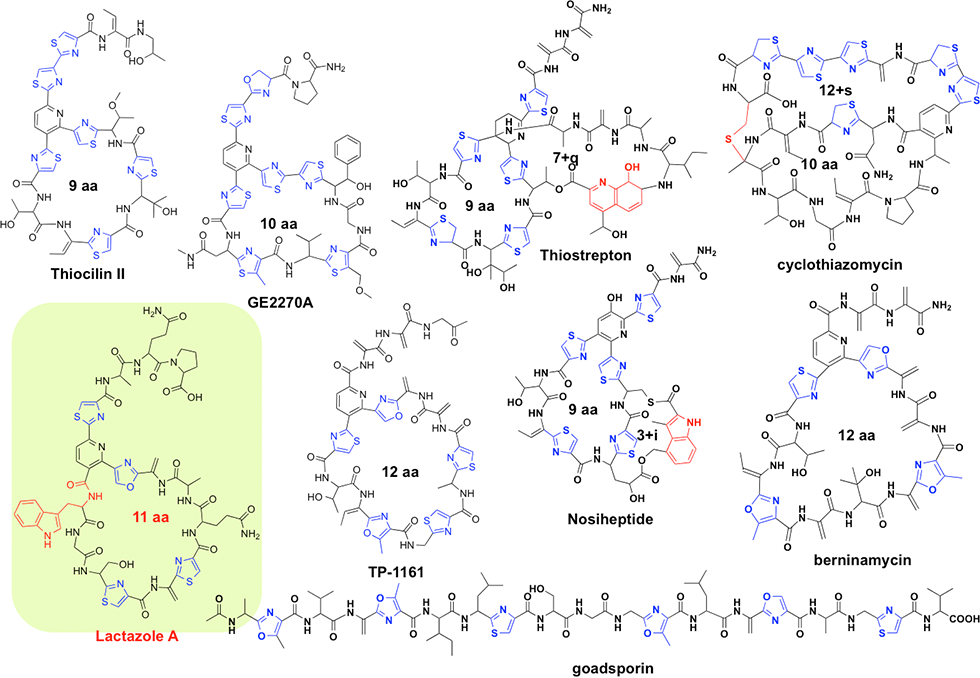
チオペプチド生合成においては、生合成遺伝子内に構造遺伝子としてチオペプチド骨格配列をコードした遺伝子が存在し、リボソームによる翻訳後、修飾酵素群によって内部アミノ酸が修飾されチオペプチドとなります。翻訳後修飾は主として、チアゾール環、オキサゾール環、デヒドロアラニンの形成であり、ここまではゴードスポリンと同じ修飾反応ですが、最後にDiels Alder縮合により大員環形成がなされるのが、チオペプチド化合物群の特徴です。私たちは、世界最小サイズのチオペプチド生合成マシナリーであるラクタゾール生合成遺伝子群を発見しており(図1-2)、本生合成系を用いた有用物質生産を目指しています。
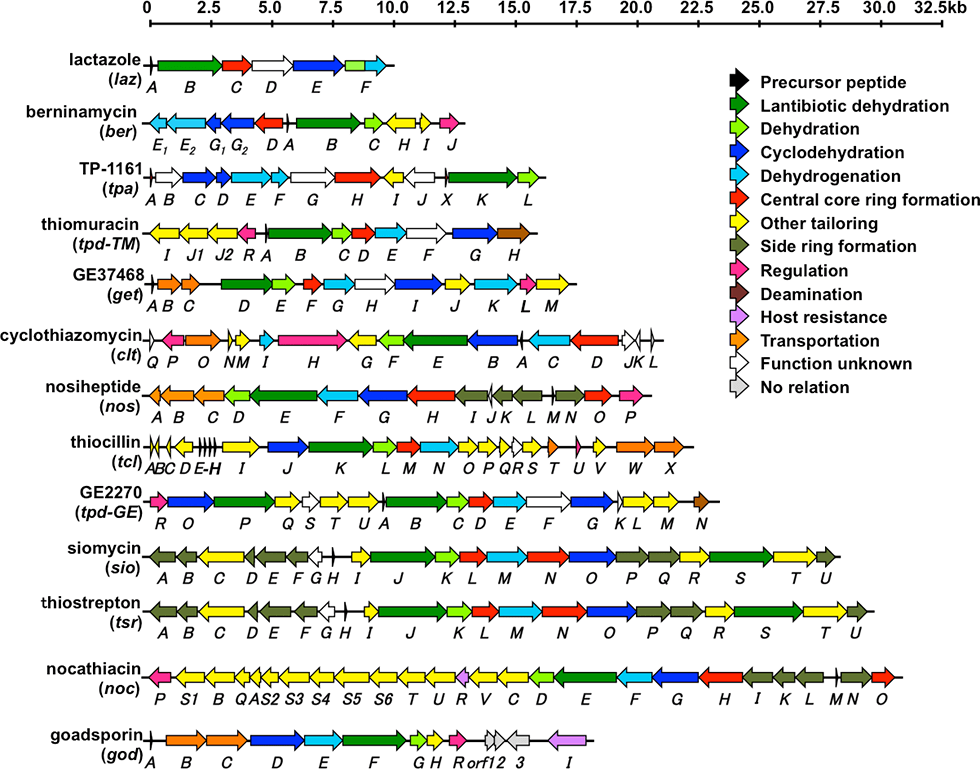
ラクタゾール(lactazole)生合成遺伝子群はStreptomyces lactacystinaeusのゲノム内に、9.8kbにわたって存在する6個の遺伝子として見出されました。私たちは、この9.8kbの領域をS. lividansにクローニングし、異種発現することにより、新規チオペプチド・ラクタゾール類の生産を確認しました。ラクタゾールは32員環(11残基)という、これまで存在しなかったチオペプチド大員環構造を有しており(図1-1)、さらにトリプトファンやグルタミン、プロリンなどの一般的なチオペプチドには見られないアミノ酸を含んでいるなど、特徴的なチオペプチドであることが分かりました。
ラクタゾール生合成研究に関する主要な参考論文
(2) ペプチド系抗生物質の構造多様性拡張技術の開発
微潜研ではRiPPsの生合成反応を全て試験管内でのワンポット反応として再現することに世界で初めて成功しています。このシステムは無細胞翻訳系と翻訳後修飾反応系を共役させたシステムであり、最初に前駆体ペプチド遺伝子を反応チューブに投入するだけで、一晩でゴードスポリン, ラクタゾールおよびそれらのアナログ体が合成されます(図2-1)。本系はアミノ酸配列の異なる多様なRiPPs類縁体を一晩で迅速簡便に合成することができる画期的なシステムです。
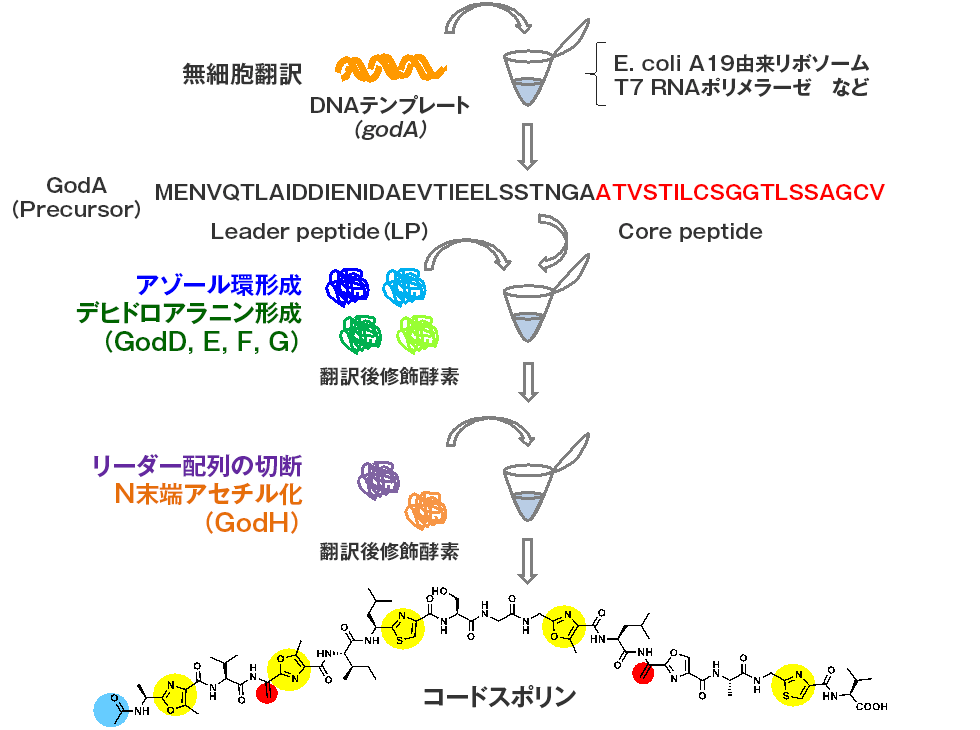
ゴードスポリン(GS)の化学構造(下)、GSにはセリン、スレオニン、システインが脱水縮合することによって生じたオキサゾール、チアゾール環が内部に6個存在し(黄色)、セリンが脱水することによって生じるデヒドロアラニンが2個存在する(赤色)。構造遺伝子であるgodAを反応チューブに投入することにより、無細胞翻訳、翻訳後修飾反応が順次行われて、GSが合成される。本システムを使うとgodAの塩基置換体をテンプレートとすることにより、多様なアナログ体を24時間で迅速簡便に合成することができる。
ラクタゾールアナログの創製に関しては、マクロ環化酵素LazCの基質認識が寛容であることが明らかになったため、様々な環サイズのアナログや、環内のアミノ酸配列がオリジナルとは全く異なるアナログ体の創製にも成功しています。また、無細胞翻訳系の利点を活かして、非タンパク質性アミノ酸の導入にも成功しています(図2-2)。
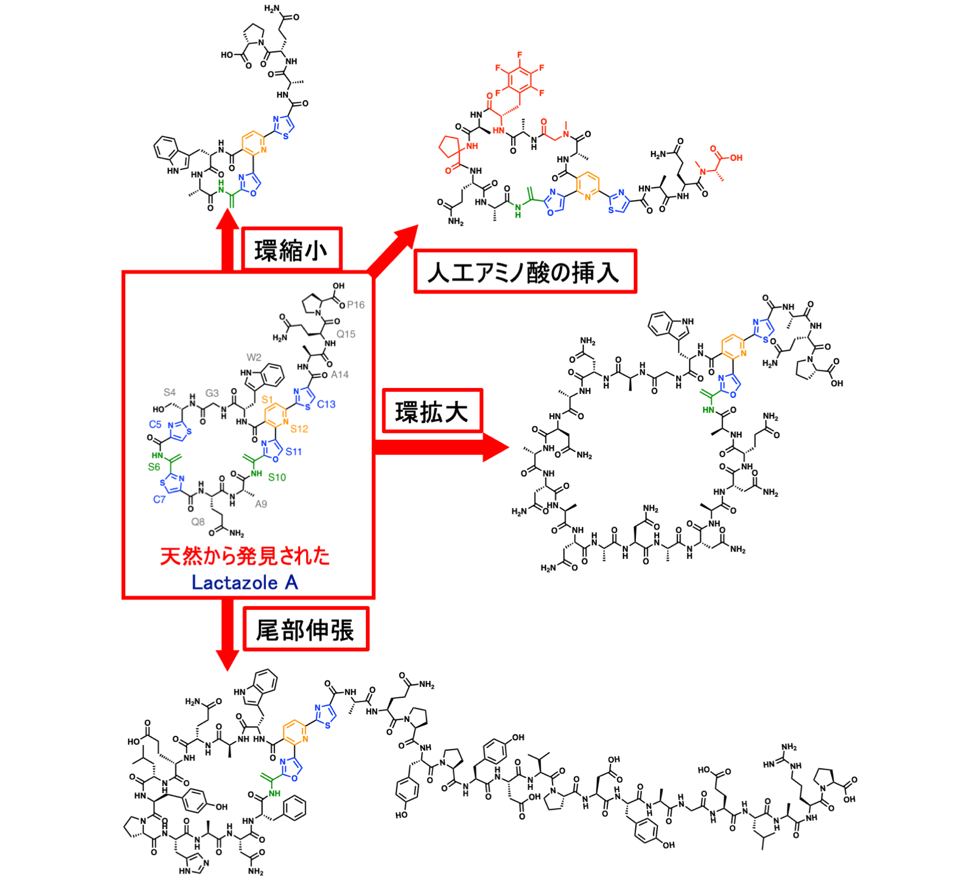
自然界に存在する天然物の化学構造多様性を遙かに凌ぐ化学構造が本研究により生み出された。人工アミノ酸挿入では、タンパク質を構成する20種類のアミノ酸以外のアミノ酸の導入に成功している。また、マクロ環サイズは最小5残基から最大21残基まで様々な環サイズを創出することが出来る。尾部伸張においては尾部のアミノ酸残基を伸ばしただけでなく、アミノ酸配列がオリジナルなラクタゾールとは全く異なっており、もはやラクタゾールアナログとは判別できない構造となっている。
RiPPsの多様なアナログ体創製に関する主要な参考論文
- A. A. Vinogradov, M. Shimomura, Y. Goto, T. Ozaki, S. Asamizu, Y. Sugai, H. Suga*, H. Onaka*. Minimal lactazole scaffold for in vitro thiopeptide bioengineering. Nature Communications, 11, 2272 (2020)
ラクタゾール生合成の試験管内ワンポット反応とそれによる多様なラクタゾールアナログ創製に関する論文 - T. Ozaki, K. Yamashita, Y. Goto, M. Shimomura, S. Hayashi, S. Asamizu, Y. Sugai, H. Ikeda, H. Suga*, and H. Onaka*. Dissection of goadsporin biosynthesis by in vitro reconstitution leading to designer analogs expressed in vivo. Nature communications, e14207 (2017)
ゴードスポリン生合成の試験管内ワンポット反応とそれにより、全52種類のゴードスポリンアナログの創製に成功した
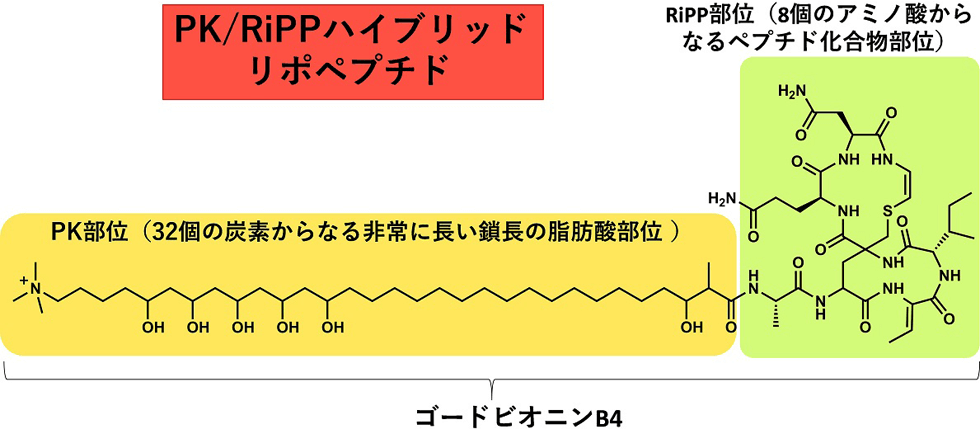
(3) 新規リポペプチド・ゴードビオニン
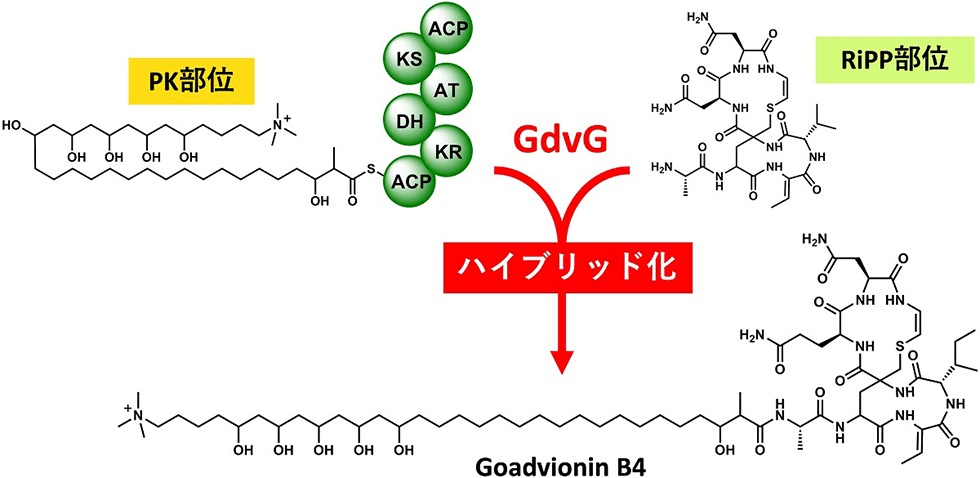
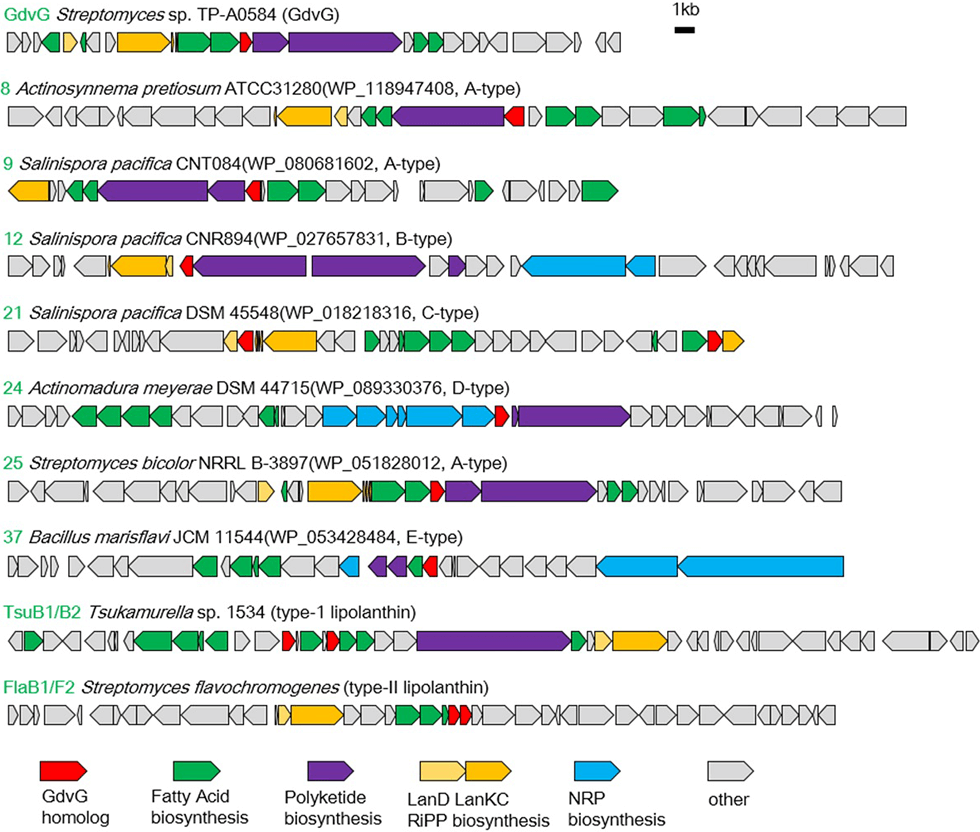
ゴードビオニンは既知のリポペプチドの作られ方とは全く異なる生合成経路によって産生するPK/RiPPsハイブリッド天然物です(図3-1)。これまで報告されているリポペプチドのほとんどはNRPS(非リボゾーム合成酵素)によって作られますが、ゴードビオニンはRiPPsと脂肪酸が新規アシルトランスフェラーゼによって転移して合成されます(図3-2)。